Bài Tập Vẽ Sơ đồ Cấu Tạo Nguyên Tử là một phần quan trọng trong chương trình học hóa học, giúp học sinh hình dung và hiểu rõ hơn về cấu trúc cơ bản của vật chất.
 Sơ đồ cấu tạo nguyên tử Hidro
Sơ đồ cấu tạo nguyên tử Hidro
Tầm Quan Trọng Của Việc Nắm Vững Sơ Đồ Cấu Tạo Nguyên Tử
Nguyên tử là đơn vị cơ bản cấu tạo nên mọi vật chất xung quanh ta. Hiểu rõ cấu tạo của nguyên tử, cách các electron sắp xếp trong các lớp vỏ sẽ là nền tảng vững chắc để bạn:
- Nắm vững bảng tuần hoàn: Dựa vào sơ đồ cấu tạo nguyên tử, ta có thể dự đoán được tính chất hóa học của các nguyên tố trong bảng tuần hoàn.
- Nghiên cứu liên kết hóa học: Sơ đồ cấu tạo nguyên tử cho ta biết số electron lớp ngoài cùng, từ đó dự đoán được khả năng tạo liên kết của nguyên tử.
- Ứng dụng trong khoa học và đời sống: Kiến thức về cấu tạo nguyên tử được ứng dụng rộng rãi trong nhiều lĩnh vực như vật liệu, năng lượng, y học,…
Các Bước Vẽ Sơ Đồ Cấu Tạo Nguyên Tử
Để vẽ sơ đồ cấu tạo nguyên tử, bạn có thể tuân theo các bước sau:
- Xác định số proton (p), neutron (n) và electron (e) của nguyên tử: Thông tin này có thể tìm thấy trong bảng tuần hoàn các nguyên tố hóa học.
- Vẽ hạt nhân: Hạt nhân nằm ở tâm nguyên tử, chứa proton và neutron. Ghi rõ số proton (p) và neutron (n) trong hạt nhân.
- Vẽ các lớp electron: Các electron phân bố theo từng lớp xung quanh hạt nhân. Số lớp electron phụ thuộc vào số electron của nguyên tử.
- Sắp xếp electron vào các lớp: Mỗi lớp electron có mức năng lượng nhất định và chứa tối đa một số electron nhất định. Ví dụ, lớp thứ nhất (lớp K) chứa tối đa 2 electron, lớp thứ hai (lớp L) chứa tối đa 8 electron,…
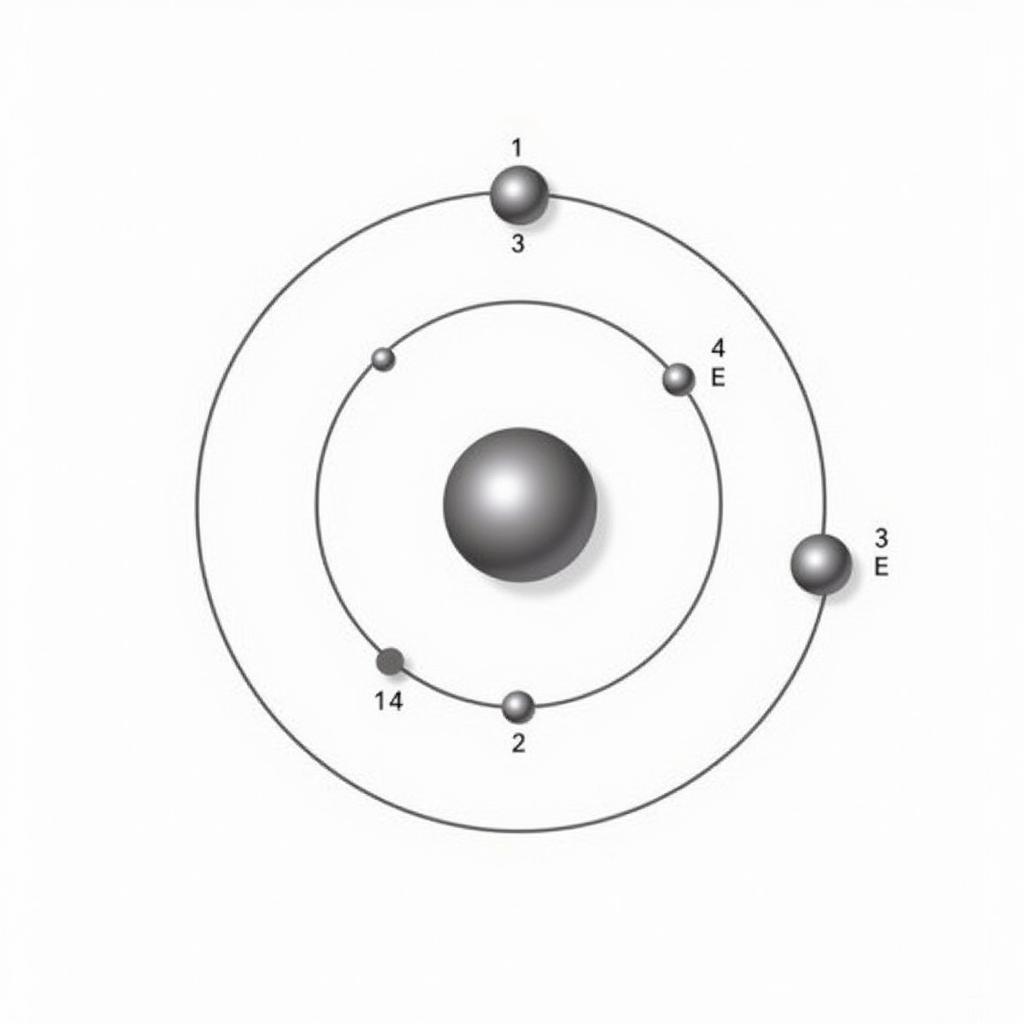 Sơ đồ cấu tạo nguyên tử Natri
Sơ đồ cấu tạo nguyên tử Natri
Ví dụ: Vẽ sơ đồ cấu tạo nguyên tử Natri (Na)
- Số proton (p) = 11, số neutron (n) = 12, số electron (e) = 11. (Thông tin lấy từ bảng tuần hoàn)
- Vẽ hạt nhân: Hạt nhân chứa 11 proton (p) và 12 neutron (n).
- Vẽ các lớp electron: Nguyên tử Na có 11 electron nên có 3 lớp electron (K, L, M).
- Sắp xếp electron: Lớp K (gần hạt nhân nhất) chứa 2 electron, lớp L chứa 8 electron và lớp M (lớp ngoài cùng) chứa 1 electron.
Một Số Lưu Ý Khi Vẽ Sơ Đồ Cấu Tạo Nguyên Tử
- Sử dụng màu sắc khác nhau: Nên dùng màu sắc khác nhau để phân biệt hạt nhân, các lớp electron và electron.
- Vẽ chính xác số lượng: Đảm bảo số lượng proton, neutron và electron trong sơ đồ chính xác với thông tin trong bảng tuần hoàn.
- Chú ý đến quy tắc bát tử: Nguyên tử có xu hướng đạt được cấu hình electron bền vững như khí hiếm gần nhất (8 electron lớp ngoài cùng) bằng cách cho nhận electron.
Bài Tập Vẽ Sơ Đồ Cấu Tạo Nguyên Tử Ứng Dụng
Ngoài việc vẽ sơ đồ cấu tạo nguyên tử đơn lẻ, bạn có thể vận dụng kiến thức này để:
- So sánh cấu tạo nguyên tử của các nguyên tố: Ví dụ, so sánh sơ đồ cấu tạo của nguyên tử Natri (Na) và nguyên tử Clo (Cl).
- Giải thích sự hình thành liên kết ion: Ví dụ, giải thích sự hình thành liên kết ion giữa nguyên tử Natri (Na) và nguyên tử Clo (Cl) để tạo thành phân tử muối ăn (NaCl).
 Liên kết ion trong phân tử muối ăn
Liên kết ion trong phân tử muối ăn
Luyện Tập Thêm Về Vẽ Sơ Đồ Cấu Tạo Nguyên Tử
Để nâng cao kỹ năng vẽ sơ đồ cấu tạo nguyên tử, bạn có thể tham khảo thêm các bài tập và tài liệu tại Lớp Học Vẽ:
Kết Luận
Vẽ sơ đồ cấu tạo nguyên tử là một bài tập quan trọng giúp bạn hiểu sâu hơn về cấu trúc cơ bản của vật chất. Bằng cách luyện tập thường xuyên và vận dụng linh hoạt kiến thức, bạn sẽ dễ dàng nắm vững nội dung này và ứng dụng hiệu quả trong học tập và nghiên cứu.
FAQ
1. Tại sao cần phải học vẽ sơ đồ cấu tạo nguyên tử?
Học vẽ sơ đồ cấu tạo nguyên tử giúp bạn hình dung và hiểu rõ hơn về cấu trúc của nguyên tử, từ đó nắm vững các khái niệm cơ bản của hóa học và ứng dụng vào thực tế.
2. Làm thế nào để nhớ được số electron tối đa trong mỗi lớp electron?
Bạn có thể áp dụng công thức 2n², trong đó n là số thứ tự của lớp electron. Ví dụ, lớp K (n=1) chứa tối đa 2.1² = 2 electron.
3. Có phần mềm nào hỗ trợ vẽ sơ đồ cấu tạo nguyên tử không?
Có nhiều phần mềm hỗ trợ vẽ sơ đồ cấu tạo nguyên tử như ChemDraw, MarvinSketch,…
Bạn cần hỗ trợ?
Liên hệ với Lớp Học Vẽ ngay hôm nay để được tư vấn và hỗ trợ:
- Số Điện Thoại: 02933878955
- Email: lophocve@gmail.com
- Địa chỉ: QCRW+366, Vị Tân, Vị Thanh, Hậu Giang, Việt Nam.
Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.